控江中学《开发海水中的卤素资源》单元测试题
班级:__________ 名字:__________ 学号:__________ 得分__________
相对原子水平:
H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 S—32 Cl—35.5 Cu—64
1、选择题(每小题只有1个正确答案,共45分)
1.在氯水中存在多种分子和离子,可通过实验的办法加以确定,下列说法中可能错误的是
A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在
B.加入有色布条后,有色布条褪色,说明有HClO分子存在
C.氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
![]() 2.在以下化学反应中能证明次氯酸是一种弱酸的是
2.在以下化学反应中能证明次氯酸是一种弱酸的是
A.Cl2 + H2O ® HCl + HClO B.2HClO ® 2HCl+O2↑
C.Ca2 + 2HCl ® CaCl2 + 2HClO D.Ca2 + CO2 + H2O ® CaCO3↓+ 2HClO
3.下列说法正确的是
A.氯化氢在空气中呈白雾
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.金属铁跟氢溴酸直接反应可制取溴化铁
D.氟气通入氯化钠水溶液中可制取氯气
4.湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体中可能有
①Cl2 ②HI ③H2S ④溴蒸气 ⑤HCl
A.①③④ B.①②⑤ C.①④ D.②④⑤
5.卤素单质(从氟到碘)性质的递变规律正确的是
A.密度渐渐减小,颜色渐渐加深
B.氧化性渐渐减弱
C.还原性渐渐减弱
D.与氢化合条件渐渐困难,生成的卤化氢愈来愈稳定
6.下列试剂不可以辨别NaCl和KI两种溶液的是
A.氯水 B.硝酸银溶液 C.石蕊试液 D.淀粉溶液
7.已知K2S+I2→2KI+S↓,KCl溶液中混有KI和K2S杂质。现需要除去并离别杂质,使用的试剂和办法是:①通入适当Cl2;②加碘水;③用CCl4萃取;④过滤。加入试剂和操作顺序是
A.①④② B.④②①③ C.②④①③ D.①②③④
8.下面有关氧化还原反应的叙述正确的是
A.在反应中未必所有元素的化合价都发生变化
B.一定有一种元素被氧化,另一种元素被还原
C.非金属单质在反应中只作氧化剂
D.金属原子失电子越多,其还原性越强
9.下列反应转化关系(未配平)一定不正确的是
A.S+KOH→K2SO3+K2S+H2O B.FeO+HNO3→Fe(NO3)3+NO+H2O
C.Cu2O+H2SO4→CuSO4+Cu+H2O D.NH4NO3→N2+H2O
10.ClO2是一种消毒杀菌效率高的水处置剂,实验室可通过以下反应制得: ![]() KClO3 + H2C2O4 + H2SO4 → ClO2↑ + K2SO4 + CO2↑ + H2O(未配平)。下列有关叙述中,正确的是
KClO3 + H2C2O4 + H2SO4 → ClO2↑ + K2SO4 + CO2↑ + H2O(未配平)。下列有关叙述中,正确的是
![]() A.H2C2O4的氧化性比ClO2强
A.H2C2O4的氧化性比ClO2强
![]() B.1mol KClO3参加反应有1mol电子转移
B.1mol KClO3参加反应有1mol电子转移
![]() C.ClO2是氧化产物
C.ClO2是氧化产物
![]() D.还原产物与氧化产物的物质的量之比为1:210
D.还原产物与氧化产物的物质的量之比为1:210
11.A2、B2、C2三种单质和它们的离子间能发生下列反应:2A—+C2®2C—+A2,2C—+B2®2B—+C2。若X—能与C2发生反应:2X—+C2®2C—+X2,有关说法中不正确的是
A.氧化性B2>C2>A2 B.还原性X—>C—>B—
C.X2与B—能发生反应 D.X2与B—不可以发生反应
12.m g二氧化锰与肯定体积的过量浓盐酸反应,得到标准情况下氯气 n L, 下列数据表示反应中盐酸作为还原剂的物质的量,其数据正确的是
A.2n/22.4 B.m/87 C.4m/87 D.n/22.4
13.锌与非常稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
A.2mol B.1 mol C.0.5mol D.0.25mol
14.11P + 15CuSO4 + 24H2O ® 5Cu3P + 6H3PO4 + 15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是
A.6:5 B.5:6 C.11:5 D.11:6
15.有KCl和KBr的混合物3.87g,溶于水配成溶液。向溶液中加入足量的硝酸银溶液,得到的沉淀干燥后是6.63g。则混合物中的钾元素的水平分数为
A.50% B.60% C.40.3% D.30%
2、填空题(共55分)
16.(共16分)配平下列化学反应方程式,并用单线桥标出电子转移的方向和数目:
(1)__________Cu + __________H2SO4 ® __________Cu + __________SO2 + __________H2O
(2)__________FeCl3 + __________SO2 + __________H2O ® __________FeCl2 + __________H2SO4 + __________HCl
(3)__________KMnO4 + __________H2S + __________H2SO4 ®__________K2SO4 +__________MnSO4 + __________S¯ + __________H2O
(4)__________Al2O3 + __________N2 + __________C ® __________AlN + __________CO
__________
17.(共10分)阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人体内含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有益于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,借助酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(甲醛用CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、办法和渠道。这说明亚铁离子具备__________性(填“氧化”或“还原”),铁离子具备__________性(填“氧化”或“还原”),(1)中的维生素C是__________剂(填“氧化”或“还原”),(2)中的CO2是__________剂(填“氧化”或“还原”),写出(2)中的__________方程式:__________
__________。
18.(12分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
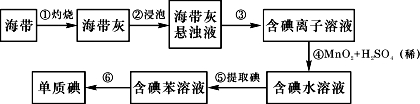
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名字是__________;步骤⑤的实验操作名字是__________,操作要点__________。
(3)假设溶液中含碘离子的物质为NaI,步骤④反应的化学方程式是__________
__________。
(4)步骤⑤中,某学生选择用苯来提取碘的原因是__________。
__________
19.(共17分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+和Br2哪个的氧化性更强。
(2)猜想:
①甲同学觉得氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__________ (填化学式,下同)所致
②乙同学觉得氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________ 所致。
(3)设计实验并验证
丙同学为验证乙同学的看法,使用下列某些试剂设计出两种策略进行实验,并通过察看实验现象,证明了乙同学的看法确实是正确的。
除氯化亚铁溶液和溴水外,还有供使用的试剂:a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学使用的试剂及实验中察看到的现象(试剂填序号)
| 使用试剂 | 实验现象 |
策略1 |
|
|
策略2 |
|
|
(4)结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为______________________________。
(5)实验后的考虑:
①依据上述实验推断,若在溴化亚铁溶液中通入氯气,第一被氧化的离子是__________ (填离子的化学式)。
②在100mLFeBr2溶液中通入2.24L Cl2(标准情况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为__________ 。
答卷卷
班级:__________ 名字:__________ 学号:__________ 得分__________
1、选择题
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 |
|
|
|
|
|
|
|
|
题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
|
答案 |
|
|
|
|
|
|
|
2、填空题
16.______________________________
(1)__________Cu + __________H2SO4 ® __________Cu + __________SO2 + __________H2O
(2)__________FeCl3 + __________SO2 + __________H2O ® __________FeCl2 + __________H2SO4 + __________HCl
(3)__________KMnO4 + __________H2S + __________H2SO4 ®__________K2SO4 +__________MnSO4 + __________S¯ + __________H2O
(4)__________Al2O3 + __________N2 + __________C ® __________AlN + __________CO
__________
17.______________________________性,______________________________性,______________________________剂,______________________________剂。
__________方程式:______________________________。
18.(1)__________
(2)__________;______________________________,______________________________。
(3)______________________________。
(4)______________________________。
19(2)①______________________________②__________________________________________________
(3)
| 使用试剂 | 实验现象 |
策略1 |
|
|
策略2 |
|
|
(4)__________________________________________________。
(5)①______________________________②______________________________ 。







